Kimyanın Temel Yasaları Konu Anlatımı

Kimya ayt konu anlatımı, Kimya tyt konu anlatımı , Kimya yks konu anlatımı… Merhaba arkadaşlar sizlere bu yazımızda Kimyanın Temel Yasaları hakkında bilgi vereceğiz. Yazımızı okuyarak bilgi edinebilirsiniz..
Kimyanın Temel Yasaları
Kimyanın en önemli özelliklerinden biri ölçmeye dayalı olmasıdır. Deneysel sonuçların ölçülmesi ve yorumlanması kimyanın temel
kanunlarının ortaya çıkmasına neden olmuştur. Kimyanın temel kanunları üç kısma ayrılır.
- Kütlenin Korunumu Kanunu
- Sabit Oranlar Kanunu
- Katlı Oranlar Kanunu
- Birleşen Hacim Oranları Yasası
- Sabir Hacim Oranları Yasası
Kütlenin Korunumu Kanunu
Kütlenin korunumu kanunu Antoine Laurent de Lavoisier tarafından ortaya konmuştur. Lavosier, bir miktar kalay ve hava bulunan cam balonun ağzını kapatarak tartmıştır. Daha sonra kabı ısıtmış ve kalayın beyaz bir toza (SnO) dönüştüğünü görmüştür. Son durumda kabı yeniden tartmış ve kütlenin değişmediğini bulmuştur. Lavoiser yaptığı benzer deneyler sonucunda kütlenin korunumu kanununu ifade etmiştir.
Bir tepkimede tepkimeye giren maddelerin kütleleri toplamı oluşan ürünlerin kütleleri toplamına eşittir. Bu kanuna kütlenin korunumu kanunu denir.
Kütlenin korunumu kanunu;
– Erime,donma,buharlaşma,yoğunlaşma gibi hal değişimleri ile çözünme gibi fiziksel olaylarda da korunur.
– Kimyasal olaylara giren maddelerin kütleleri toplamı, elde edilen ürünlerin kütleleri toplamına eşittir.
Örnek :
Sn(k) + 1/2O2(g) → SnO(k)
238 g + 32 g = 270 g
Sabit Oranlar Kanunu
Dalton Atom Teorisinin varsayımında bir bileşik oluşturabilmek için belli elementlerin belirli sayıdaki atomlarına gereksinim duyulacağı belirtilmiştir. Aslında bu fikir Fransız kimyacı Joseph Proust tarafından yayınlanan bir yasanın uzantısıdır. 1799 yılında Proust, elementler birbirleri ile bileşik oluştururken belli oranda birleştiklerini göstermiştir. Bugün “Sabit Oranlar kanunu” olarak bilinen bu kanuna göre, “bir bileşiğin farklı örneklerinde bileşiği oluşturan elementler kütlece daima aynı oranda bulunurlar.”
H2 (g) +O2 (g)→ H2O (g)
2 g + 16 g = 18 g
Kütlece hidrojenin oksijene oranı daima m H / m O = 2/16 = 1/8’ dir.
Örnek1 :
32 gram ![]() bileşiğinde 24 gram C, 8 gram H elementi yer almaktadır. Durum böyleyken
bileşiğinde 24 gram C, 8 gram H elementi yer almaktadır. Durum böyleyken ![]() bileşkesinde elementlerin kütle bileşme oranları kaçtır?
bileşkesinde elementlerin kütle bileşme oranları kaçtır?
Çözüm:
![]()
![]() bileşiğinin 44 gramında 12 gram C ( karbon ) elementi yer almaktadır. Bu durumda 128 gram O ( oksijen ), kaç gram C ( karbon) ile bileşik oluşturmuştur.
bileşiğinin 44 gramında 12 gram C ( karbon ) elementi yer almaktadır. Bu durumda 128 gram O ( oksijen ), kaç gram C ( karbon) ile bileşik oluşturmuştur.
Çözüm:
Verileri yazarak başlayalım
44 gram ![]() bileşkesinde 12 gram C ( karbon ) bulunuyorsa, geri kalanı yani 32 gramı oksijen ( O ) dir.
bileşkesinde 12 gram C ( karbon ) bulunuyorsa, geri kalanı yani 32 gramı oksijen ( O ) dir.
32 gram oksijen ( O ) 12 gram karbon ( C ) ile birleşmişse
128 gram oksijen kaç gram karbon ile birleşmiştir? bilinmeyen karbonu X olarak ele alalım ve içler dışlar çarpımı yapalım.
X . 32 = 128 . 12
X = 1536 / 32
X = 48
Bu bileşiğin içerisinde 48 gram karbon yer almaktadır.
Katlı Oranlar Kanunu
Kimyasal birleşmenin iki yasasından yararlanan John Dalton (1803-1808) tarihleri arasında bir atom kuramı geliştirdi.
Dalton Kütlenin Korunumu Yasası ve Sabit Oranlar Yasasından yola çıkarak maddeyi oluşturan ve onun bütün özelliklerini gösteren çok küçük parçacıkların olduğu yorumunu yapmış ve Katlı Oranlar Kanunu’nu ortaya atmıştır, buna göre; iki element birden fazla bileşik oluşturuyorsa, birinin belli bir miktarına karşılık, diğerinin değişken miktarları arasında küçük ve tam sayılarla ifade edilen bir oran vardır.
Karbon elementiyle oksijenin oluşturduğu iki bileşik vardır bunlar karbon mono oksit (CO) ve karbon di oksit (![]() ). Karbon monoksit bileşiğinde bir karbon atomu ile bir oksijen atomu birleşirken, Karbondioksit bileşiğinde bir karbon atomu ile iki oksijen atomu birleşir. Her iki bileşikte karbon atom sayıları sabit tutulduğunda oksijen atomları arasında 1/2 oranının olduğu gözlenir.
). Karbon monoksit bileşiğinde bir karbon atomu ile bir oksijen atomu birleşirken, Karbondioksit bileşiğinde bir karbon atomu ile iki oksijen atomu birleşir. Her iki bileşikte karbon atom sayıları sabit tutulduğunda oksijen atomları arasında 1/2 oranının olduğu gözlenir.
Katlı Oranlar Kanunu’na uyan bileşik ve elementlerle ilgili;
– Bileşikler iki tür element içermelidirler
– Bileşiklerdeki element türleri aynı olmalıdır
– Bileşiklerin basit formülleri aynı olmamalıdır.
Örnek soru:
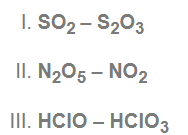
yukarıdaki bileşik çiftlerden hangilerine katlı oranlar kanunu uygulanır?
Çözüm:
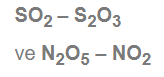
İkili bileşik çiftlerinde elementler aynı, oranlar farklı.
Katlı oran uygulanabilir.
![]()
Üçlü bileşiklere Katlı oran uygulanmaz.
Birleşen Hacim Oranları Yasası
Dalton Atom Teorisi ile Kimya bilim tarihinde çığır açan John Dalton atmosfer olaylarını incelemeye başladı ve bu konu ile ilgili deneyler yaptı. Aynı yıllarda gazlarla ilgili başka bilim adamlarının da çalışmaları başladı. jc1787’de Fransız Fizikçi Jacques Charles yaptığı deneylerde sabit basınçtaki belli bir miktar gazın hacminin sıcaklık arttıkça arttığını keşfetti.
Gazların bu özelliği Joseph Gay-Lusac’ın da dikkatini çekti ve gazlarla ilgili araştırmalar yaptı. 19. yüzyılın başlarında gazlarla ilgili yapmış olduğu deneylerin sonuçlarını yayımlayan Gay Lussac; Gazların birleşen hacimleri arasındaki oranın gazların birleşen tanecik sayıları arasındaki oranı verdiğini ileri sürdü.
Ancak bu teori Dalton tarafından kabul edilmedi. Dalton elementlerin atomik yapılı olduğunu düşünüyor, yapılı olamayacağını söylüyordu. Bundan dolayı suyun oluşma denkleminin şu şekilde olduğunu söylüyordu :

Dalton bu söylediklerine deneysel verilerle ulaşamadı. Deney sonuçları söylediği oranlarda çıkmadı.
Bu soruna Avogadro açıklık getirdi. İtalyan Fizikçi Amedeo Avogadro , Dalton ve Gay-Lussac yasalarından yola çıkarak gazlarla ilgili yaptığı deneyler sonucu ; gaz halindeki elementlerin bazılarının atomik yapılı, bazılarının ise molekül yapılı olabileceğini düşündü ve “Aynı sıcaklık ve basınçta, gazların eşit hacimlerinde eşit sayıda atom ve molekül içerir.” diyerek, Avagadro hipotezini ortaya attı ve kimya tarihine bu şekilde molekül kavramı da girmiş oldu.
Bunun sonucu olarak Gay Lussac tarafından ifade edilen ; “Sabit basınç ve sıcaklıkta gazların birleşen hacimlerinin oranı tanecik sayılarının oranını verir.” yargısını doğrulanmış oldu.

Sabit Hacim Oranları Yasası
Aynı şartlarda gaz reaksiyonlarında reaksiyona giren gazların ve reaksiyon sonunda oluşan gazların hacimleri arasında basit tam sayılarla ifade edilen bir oran vardır. Aynı şartlarda gazların hacimleri ile mol ve molekül sayıları doğru orantılıdır. Yani gazların mol sayıları yerine hacimleri, hacimlerinin yerine de mol sayıları alınabilir. Aynı şekilde gaz reaksiyonlarında aynı şartlarda gazların mol sayılarının yerine basınçları basınçlarının yerine de mol sayıları alınabilir.







Çok güzel olmuş elinize sağlık 🙂
Katlı oranlar kanunu için örnek:Fe2 O3 ve FeO bileşiklerinde eşit Fe atomlarına karşı birleşen O atomları arasındaki katlı oran 3\2 dir.
Fe2 O3 = Fe2 O3
2\Fe0 =Fe2 O2
Oksijenler arası katlı oran 3\2 dir.
Örnekler de verselerdi çok iyi olurdu..
tşk ama gereksiz uzun :ı
Kısalt
Kısalt
kısalt
Teşekkür ederizz
çok yardımcı oldu teşekürler