Karbon Kimyasına Giriş Konu Anlatımı

Kimya ayt konu anlatımı, Kimya tyt konu anlatımı , Kimya yks konu anlatımı… Merhaba arkadaşlar sizlere bu yazımızda Karbon Kimyasına Giriş hakkında bilgi vereceğiz. Yazımızı okuyarak bilgi edinebilirsiniz..
Karbon Kimyasına Giriş
- Anorganik Ve Organik Bileşikler
- Basit Formül Ve Molekül Formülü
- Doğada Karbon
- Lewis Formülleri
- Hibritleşme-Molekül Geometrileri
Anorganik Ve Organik Bileşikler
Erime ve kaynama noktaları düşük, karbon atomu içeren, ana kaynağı genellikle canlılar olan bileşiklere organik bileşik denir.
Organik olmayan bileşiklere anorganik bileşik denir. Erime ve kaynama noktaları organik bileşiklerden daha yüksek olan asit, baz, tuz ve oksit sınıfı bileşikler anorganik bileşiklerdir.
Organik Bileşiklerin Özellikleri
– Ana kaynağı canlılar ve canlı kalıntılarıdır (petrol, doğal gaz, kömür vb.).
– Erime ve kaynama noktaları genellikle düşüktür.
– Tepkimeleri çok yavaştır.
– Genellikle kendilerine özgü kokuları vardır.
– Yanıcıdır. Genellikle yanıcı değildir.
– Doğadaki sayıları çok fazladır.
– Genellikle kovalent bileşiklerdir
Anorganik Bileşiklerin Özellikleri
– Ana kaynağı doğadaki minerallerdir (tuzlar, oksitler, asitler, bazlar vb.).
– Erime ve kaynama noktaları genellikle yüksektir.
– Tepkimeleri genellikle hızlıdır.
– Genellikle kendilerine özgü kokuları yoktur.
– Genellikle yanıcı değildir.
– Doğadaki sayıları organik bileşiklere göre daha azdır.
– Genellikle iyonik bileşiklerdir.
Kimyanın organik bileşikleri inceleyen alt disiplinine organik kimya (karbon kimyası), anorganik bileşikleri inceleyen alt disiplinine ise anorganik (inorganik) kimya denir.
Basit Formül Ve Molekül Formülü
Organik bileşiklerdeki elementlerin türünü, atom sayılarının birbirine oranlarını gösteren formüle basit formül (kaba formül) denir. Bu formülde elementlerin mol sayıları en küçük tam sayılarla yazılır. Bir bileşiğin basit formülünden;
– Bileşiği oluşturan atomların türü,
– Atom sayılarının oranları,
– Elementlerin atom kütleleri biliniyorsa bileşiği oluşturan elementlerin kütleleri oranı ve kütlece yüzde bileşimleri bulunabilir.
Organik bileşiği oluşturan elementlerin gerçek atom sayılarının verildiği formüle o bileşiğin molekül formülü (gerçek formül) denir. Bir bileşiğin molekül formülü ile;
– Bileşiği oluşturan atomların türü,
– Atom sayıları ve atom sayılarının oranları,
– Elementlerin atom kütleleri biliniyorsa bileşiğin molekül ağırlığı, atomların kütlece yüzde bileşimleri ve elementlerin kütleleri oranı
bulunabilir.
n *(Basit formül) = Molekül formülü
n *(Basit formülü verilen bileşiğin molekül kütlesi) = Molekül kütlesi
Bir moleküldeki atomların gerçek sayılarının ve bağlanma şekillerinin gösterildiği formüle yapı formülü (açık formül) denir.
Doğada Karbon
Karbon Elementinin Özellikleri
– Periyodik çizelgenin 14. grubunda (4A) yer alan karbonun değerlik elektron sayısı 4’tür.
– Karbon atomu dört değerlik elektronları kullanarak toplam dört bağ (kovalent) yapabilir.
– Bir karbon atomu bir başka karbon atomu ile tekli, ikili ve üçlü bağ yapabilir.
– Karbon atomları arasında bağlar oluşurken açığa çıkan enerji fazla olduğundan oluşan bu bağlar diğer atomların kendi aralarında – yaptıkları bağlara göre daha kararlıdır.
– Karbon elementi diğer atom veya atom gruplarıyla çok sayıda bağ yapabilir.
– Karbon atomu düz ve dallanmış zincirli, halkalı, aromatik yapıya sahip çok sayıda bileşik oluşturur.
Karbonun Allotropları
Aynı tür atomların farklı sayı ve dizilişte bir araya gelmesiyle oluşan maddelere allotrop denir.Elmas, grafit ve fullerenler karbon atomunun allotropudur.
Elmas: Karbonun düzgün kristal yapıya sahip olan bu allotropu tarih boyunca insanoğlunun zenginliğinin ve gösterişinin simgesi olmuştur.
Grafit: C atomları üst üste yığılmış geniş, yassı levhalar oluşturacak biçimde iki boyutlu düzlemde birbirine bağlanmıştır.
İyi bir yağlayıcıdır. Elektriği iletir. Pilde ve elektrolizde elektrot olarak kullanılır.
Fulleren: Belirli sayıda karbon atomunun bir araya getirilmesiyle oluşturulan fulleren; top, tüp, çubuk ve halka şeklinde sınıflandırılabilen yapay bir allotroptur . Yapı olarak grafite benzemekle birlikte tabakaları grafitinki gibi değildir. Karbon atomları fullerenin tabakalarında beşgen, altıgen veya yedigen halkalar olarak dizilebilir. Bu halkaların ana düzlemlerinin kıvrılması ile küresel yapılar oluşturulabilir.
Grafen: Sadece karbon atomlarından oluşan sistemler arasında karbon atomunun iki boyutlu allotropu olan grafen, diğer allotropların
elektronik özelliklerinin anlaşılabilmesi açısından son derece önemli bir yere sahiptir.
Lewis Formülleri
Kovalent Bağlı Bileşiklerin Lewis Formülleri
Elementlerin oluşturacağı kovalent bağ sayısını o elementlerin değerlik elektronları belirler. Bir elementin son katmanındaki elektronlara o elementin değerlik elektronları denir. Elementler kovalent bağ oluştururken değerlik elektronlarını ortaklaşa kullanır.
Ancak elementlerin değerlik elektronlarının hepsi bağ oluşumuna katılmayabilir. Molekül formüllerinde bağ oluşumuna katılan elektronlara ortaklanmış (bağlayıcı) elektron denir. Bir bağ ortaklaşa kullanılan iki elektrondan oluştuğundan bağı oluşturan elektronlar bağlayıcı elektron çifti şeklinde ifade edilir. Molekülde bağ oluşumuna katılmayan elektronlara ortaklanmamış elektron, bu elektronlar çift hâlinde bulunuyorsa ortaklanmamış elektron çifti denir.
Değerlik elektronlarının, atomun sembolü etrafında noktalar hâlinde gösterilmesiyle elde edilen formüle Lewis formülü denir.Moleküllerin Lewis formülleri yazılırken atomların bağ yapan elektronları karşılıklı yazılarak eşleştirilir.
Lewis yapılarında atomlar arasındaki her elektron çifti bir kovalent bağı simgelemektedir. Bağ yapmış bu elektron çiftleri çizgiyle de gösterilebilir. Bu formüle bileşiğin çizgi bağ formülü denir.
Hibritleşme-Molekül Geometrisi
Hibritleşme Nedir?
Farklı enerjideki atom orbitallerinin enerjilerni yeniden düzenleyecek yeni orbitaller oluşturmasına hibritleşme (melezleşme) denir. Hibritleşme sonucu oluşan yeni orbitallere de hibrit orbitalleri denir.
Hibritleşme, enerji düzeyleri yakın olan orbitaller arasında olur. s ile p arasında sp, sp2 ve sp3 hibritleşmesi olmak üzere üç hibritleşme mevcuttur.
Metan molekülünde hibritleşmiş sp3 hibrit orbitalleriyle hidrojenin s orbitali uç uca örtüşerek C-H bağlarını oluşturmuştur. Bu şekilde iki orbitalin uç uca gelerek örtüşmesiyle oluşan bağlara sigma (σ) bağı denir.
Düzlemin altında ve üstünde bulunan p orbitalleri düzleme dik şekilde birbiriyle yan yana örtüşerek yeni bağ oluşturur ve oluşan bu bağa pi (π) bağı denir.
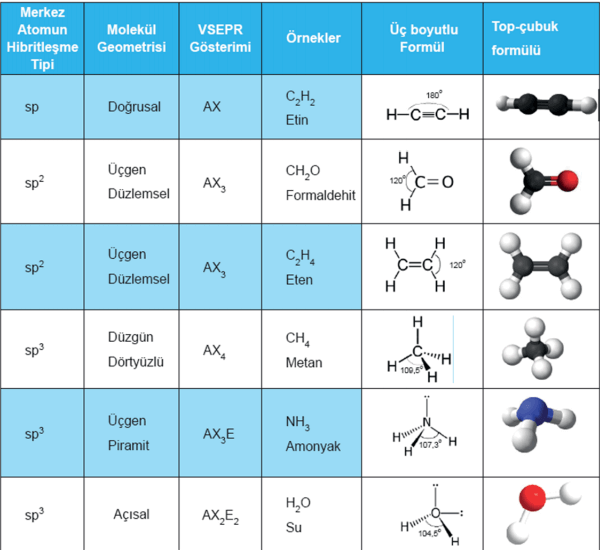
Molekül Geometrisi
Merkez atomun ve merkez atoma bağlı diğer atomların üç boyutlu ortamda uzanımları sonucunda oluşan şekle molekül geometrisi denir.
Molekül geometrisi, değerlik kabuğu elektron çifti itme kuramına (VSPER) göre belirlenir.
Molekül geometrisi belirlenirken, hibrit orbitallerinin özdeş olması ve üç boyutlu mekanda birbirinden olabildiğince uzak durması (aradaki açının en büyük olması) ilkesinden yararlanılır.
A, merkez atomunu; E, elektron çiftini; X, bağlı bir atomu göstermek üzere bazı moleküllerin molekül geometrisi, merkez atomun hibritleşme türü ve bağ açısı tabloda verilmiştir.