Periyodik Sistem Konu Anlatımı

Kimya ayt konu anlatımı, Kimya tyt konu anlatımı , Kimya yks konu anlatımı… Merhaba arkadaşlar sizlere bu yazımızda Periyodik Sistem hakkında bilgi vereceğiz. Yazımızı okuyarak bilgi edinebilirsiniz..
Periyodik Sistem
- Mendeleyev ve Periyodik Sistem
- Moseley ve Modern Periyodik Sistem
- Periyodik Sistemde Yer Bulma
- Elementlerin Sınıflandırılması
- Periyodik Özelliklerin Değişimi
Birçok bilim insanı elementleri çeşitli özelliklerine göre sınıflandırmaya çalışmıştır. Günümüzdeki periyodik tabloya en yakın sınıflandırma 1869 yılında Julius Lothar Mayer (Julis Lother Mayer) ve Dimitri Mendeleyev’in (Dimitri Mendeleyev) çalışmalarına dayanmaktadır.
Mendeleyev ve Periyodik Sistem
1869 yılında Rus kimyacı Dimitri Mendeleyev ve 1870 yılında Alman kimyacı Lothar Meyer yaptıkları çalışmaların sonuçlarını bilim dünyası ile paylaştılar.
Her iki bilim insanının yaptığı çalışmada da elementler atom ağırlıklarına ve benzer özelliklerine göre sınıflandırılmıştır. Meyer 28 elementi karşılaştırarak bir tablo oluştururken, Mendeleyev 63 elementi içeren bir tablo oluşturmuştur.
Mendeleyev daha fazla elementi daha iyi açıkladığı için Meyer’in çalışması gölgede kalmış ve Mendeleyev’in oluşturduğu periyodik sistem tablosu günümüzdeki tablonun ilk örneği olarak kimya literatüründe yerini almıştır.
– 63 elementi sınıflandırmıştır.
– Bu sıralamada elementlerin fiziksel ve kimyasal özelliklerinin de düzenli (periyodik) olarak tekrarladığını görmüştür.
– Mendeleyevin bu tabloda sıralama yaparken yanılgısı elementlerin özelliklerinin atom kütlelerine bağlı olduğunu düşünmesiydi.
Mendeleyev hiç bir yeni element keşfedememiş olmasına rağmen, bilim dünyasına yaptığı hizmetten dolayı, 1955 yılında G. T. Seaborg başkanlığındaki Amerikalı bilim adamları tarafından sentezlenen 101 atom numaralı elemente, onun onuruna “Mendelevyum” adı verilmiştir.
Moseley ve Modern Periyodik Sistem
İngiliz fizikçi Henry Moseley (Henri Mozli), X-ışınları ile yaptığı deneylerde çeşitli elementlerin atom numaralarını bulmuştur. Elementlerin fiziksel ve kimyasal özelliklerinin atom kütlesine değil, atom numarasına (proton sayısına) bağlı olduğunu kanıtlamıştır.
Periyodik Sistem
Elementlerin benzer kimyasal ve fiziksel özelliklerine ve artan atom numaralarına göre gruplandırıldıkları çizelgeye periyodik tablo / periyodik sistem / periyodik cetvel denir.
Elementler gruplandırılırken; oda şartlarındaki fiziksel hâl, sertlik-yumuşaklık, iletkenlik, kararlılık, iyon yükü gibi özellikleri dikkate alınır. Periyodik tabloda benzer özelliğe sahip elementler alt alta dizilmiştir.
Her elementin özelliklerini ayrı ayrı belirlemek yerine, periyodik tablodaki yerine bakarak element hakkında bilgi edinilebilir. Bu durum kimya ile ilgilenenlerin işini önemli ölçüde kolaylaştırmaktadır. Periyodik tabloda;
– 7 tane periyot vardır.
– Periyotlarda soldan sağa doğru gidildikçe elementlerin proton sayıları artar.
– Aynı periyottaki elementlerin yörünge sayıları aynıdır.
– Gruplarda yukarıdan aşağıya doğru gidildikçe elementlerin proton sayıları artar.
– Gruplarda yukarıdan aşağıya doğru gidildikçe elementlerin yörünge sayıları artar.
– Aynı grupta yer alan elementlerin kimyasal özellikleri genellikle benzerdir.
– Periyodik sistemde toplam 18 tane grup yer alır.
– Bunlardan 8 tanesi A grubu, 10 tanesi B grubu elementleridir.
Periyodik Sistemde Yer Bulma
Bir elementi periyodik sistemdeki yeri nötr durumdaki elektron dağılımına göre yapılır.
Katman elektron dizilimi B grubu ve A grubu elementlerinin grup türlerinin belirlenmesi için yeterli değildir. Bu nedenle sadece A grubu elementlerinin hatta ilk 20 elementin yeri katman elektron dizilimine bakılarak kesin olarak ifade edilebilir. Bunun için 2 temel kural vardır.
– Elektron dizilimindeki katman sayısı elementin bulunduğu periyotu belirtir.
– Elektron diziliminin son katmanındaki elektron sayısı da elementin bulunduğu A grubunu belirtir.
Yani;
Katman sayısı = Periyot Numarası
Son Katmandaki elektron sayısı = Grup Numarasını verir.
Örnek: 19K (Potasyum)elementinin peridodik cetveldeki yerini bulalım.
19K: 2) 8) 8) 1) à Elementin 4 tane yörüngesi bulunduğundan element 4. periyotta yer alır.
à Elementin son yörüngesinde 1 elektron bulunduğundan 1A grubunda yer alır.
Yani 19K elementi 4. Periyot 1A grubunda yer alır.
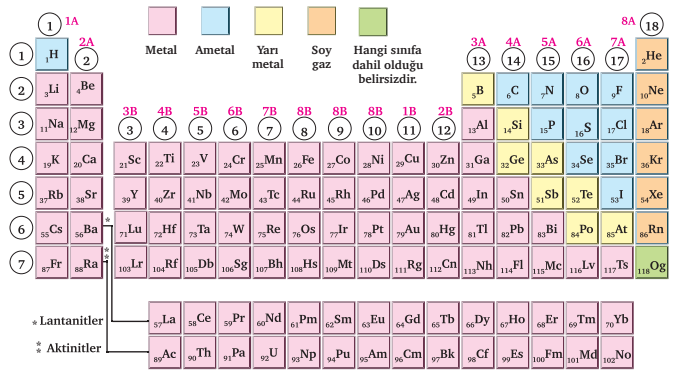
Elementlerin Sınıflandırılması
Elementler; metal, ametal ve yarı metal olmak üzere üç gruba ayrılmaktadır.
Metaller
Bilinen elementlerin büyük çoğunluğu metaldir. 1A, 2A ve 3A gruplarında büyük oranda metal vardır. B gruplarının ise tamamı metaldir.
–Cıva dışındaki metallerin tamamı oda koşullarında (25° C ve 1 atm) katı halde bulunurlar.
–Kuvvet etkisi altında işlenebilir ve şekil verilebilir.
–Parlak bir yüzeye sahiptirler.
–Elektrik akımını ve ısıyı iyi iletirler.
–Sadece elektron vererek bileşik oluşturabilirler. Yani bileşiklerinde daima pozitif (+) yüklüdürler. Bu nedenle birbirleriyle bileşik oluşturamazlar.
–Isıtılarak eritildiklerinde birbirleri ile homojen karışırlar ve oluşan bu karışım alaşım olarak adlandırılır.
NOT: 1 A grubunun 1.elementi olan hidrojen metal değildir.
Ametaller
Genellikle son katmanında 4, 5,6, 7 ve 8 elektron bulunur. Hidrojen hariç periyodik tablonun sağında bulunur.
– Tel ve levha haline getirilemez.
– Isı ve elektriği iyi iletmez.
– Mattır.
– Oda koşullarında katı, sıvı ve gaz haldedir.
– Molekül yapıdadır.
– Elektron alarak – yüklü (Anyon) oluşturur.
– Son yörüngelerinde 5,6 veya 7 elektron bulundurur.
– Periyodik sistemin sağ tarafında bulunmaktadır.
Yarı Metaller
Bor, antimon, silisyum, tellür, germanyum, polonyum, arsenik ve astatin olmak üzere toplam 8 yarı metal vardır. Yarı metaller fiziksel özellikleri bakımından metaller, kimyasal özellikleri bakımından ametallere benzerler.
– Parlak ya da mat olabilirler.
– Metallere göre az, ametallere göre ise daha iyi elektrik akımını ve ısıyı iletebilirler. (Yarı iletken özelliktedirler.)
– Yarı metaller özellikle elektronik devre parçalarının ve optik malzemelerin yapımında kullanılırlar.
– Tel ve levha haline getirilebilirler.
– Çekiçle dövülemezler. Kırılgandırlar.
Soygazlar
En kararlı element grubudur. Helyum, neon, argon, kripton, ksenon ve radon soy gazdır.
– Oda sıcaklığında gaz halinde bulunurlar.
– Elektrik akımını iletmezler.
– Bileşik oluşturmaya istekleri yoktur.
– Helyum hariç son katmanlarında 8 elektron bulunur.
– Doğada hiç bileşikleri yoktur.
– Helyum (He) hidrojenden sonra en hafif gazdır. Yanıcı ve parlayıcı değildir. Renksiz bir gazdır. Güneşte ve yıldızlarda bol miktarda bulunur. Zeplin ve balon gibi hava taşıtlarını şişirmede, derin dalış tüplerinde kullanılır.
– Neon (Ne),renksiz bir gazdır. Renkli reklam panolarının aydınlatılmasında, televizyon tüplerinde, paratonerlerde kullanılır.
– Argon (Ar), kokusuz ve renksiz bir gazdır. Ampullerde ve flüoresan tüplerinde kullanılır.

Periyodik Özelliklerin Değişimi
Periyodik cetvelin bilim insanlarına sağladığı en büyük fayda, bir elementin sadece periyodik cetvedeki yerini bilerek onun hakkında bazı bilgilere anında ulaşabilmektir. Periyodik cetvelin yapısı gereği bir takım özellikler periyodik olarak artar veya azalır. Bu özelliklere periyodik özellikler denir. Periyodik özellikler; atom yarı çapı, iyonlaşma enerjisi, elektron ilgisi, elektronegativite ve metalik-ametalik özellik olarak sıralanabilir. Periyodik özelliklerin hemen hemen hepsi elektronların orbitallere dizilişine bağlı olarak açıklanabilir (ya da daha basit bir yorumla, atomun yarıçap büyüklüğüne bağlıdır).
Atom Yarıçapı
Atomun yapısında yoğun bir çekirdek ve çekirdek etrafında elektron bulutu vardır. Elektron bulutunda elektronları yoğun olarak bulunduğu bölgeler vardır. Bir atom da atom çekirdeği ile çekirdekten en uzaktaki elektron arasındaki uzaklık atom yarıçapı olarak tanımlanır.
Bir atomun hacmi, atom yarıçapı ile doğru orantılı olduğu için atom yarıçapı aynı zamanda atom hacmi gibi kullanılır. Atom hacmi çekirdek ve elektron sayısı ile ilgilidir. Atom hacminin değişim eğilimi periyot ve gruplarda farklı şekillerde gerçekleşir.
İyon Yarıçapı
İyonik bağlı bileşiklerdeki iyonların çekirdekleri arasındaki uzaklıktan faydalanılarak hesaplanır. İyonlar aynı büyüklükte olmadığından iyon yarıçapı iyonların çekirdekleri arasındaki uzaklığın yarısına eşit değildir. Uzaklık anyon ve katyonun büyüklüğüne göre paylaştırılarak iyon yarıçapı bulunur.
İyonlaşma Enerjisi
Gaz halinde nötral bir atomdan bir elektron uzaklaştırmak için verilmesi gereken enerjiye iyonlaşma enerjisi denir. İyonlaşma enerjisi bir atomun elektronlarından birini koparıp sonsuz uzaklığa götürmek ve bir fazla artı yüklü yeni bir atom iyonu oluşturmak için gerekli enerji olarak da tanımlanabilir.
Elektronegatiflik
Bir atomun kimyasal bağda bağ yapan elektronları kendisine çekme gücüne elektronegatiflik veya elektronegativite denir.Elementlerin elektronegatifliklerini sıralayabilmek için florun elektronegatifliği 4.0 olarak kabul edilmiştir.
– Periyodik tabloda soldan sağa doğru gidildikçe atom çapı küçülür, elektronegatiflik artar.
– Aynı grupta yukarıdan aşağı doğru gidildikçe atom çapı artar, çekirdeğin çekim gücü azalır, elektronegatiflik azalır.
Metal – Ametal Özellik
Metallerin değerlik elektron sayısı genellikle az ve dolayısıyla iyonlaşma enerjileri düşüktür. Bu sebeple hidrojen hariç 1A grubu elementleri, 2A grubu elementleri, tüm B grubu elementleri, bor hariç tüm 3A grubu metaldir. Periyodik tabloda sağdan sola doğru gidildikçe, metalik özellik özellik azalır. Ancak metalik özellikler birden bitip ametallik özellik başlamaz. Metallerden ametallere geçiş süreci “yarı metaller” ile başlar.
– Metalik özellik periyodik cetvelde (aynı grup içerisinde) sağdan sola ve (aynı periyot içerisinde) yukarıdan aşağıya gittikçe artar.
– Ametalik özellik periyodik cetvelde (aynı grup içerisinde) sağdan sola ve (aynı periyot içerisinde) yukarıdan aşağıya gittikçe azalır.







Bende kimya teknolojileri okuyorum guzel olmus cok begendim
Proje odevıne son gun kala kurtarıcı olarak mukemmel olmus ellere ayaklara saglık
Ödeve son bir gün kala çok yardımcı oldu yapanın eline salık