Atom ve Yapısı Konu Anlatımı

Kimya ayt konu anlatımı, Kimya tyt konu anlatımı , Kimya yks konu anlatımı… Merhaba arkadaşlar sizlere bu yazımızda Atom ve Yapısı hakkında bilgi vereceğiz. Yazımızı okuyarak bilgi edinebilirsiniz..
Atom ve Yapısı
Atom Nedir?
Atom veya zerre, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır.
- Atomu Oluşturan Temel Tanecikler
- Atom Numarası
- Kütle Numarası
- Elektron Sayısı
- İyon Yükü
- İzotop, İzoton, İzobar Atomlar ve İzoelektronik Tanecikler
Atomu Oluşturan Temel Tanecikler
Atomun yapısında kütle ve yük bakımından farklılıklar içeren tanecikler vardır. Atomun yapısında proton, nötron ve elektron olmak üzere üç farklı temel tanecik vardır.
Bu parçacıkların dışında leptonlar ve kuarklar olarak ifade edilen daha da küçük parçacıkların olduğu da farklı teorilerle ispatlanmıştır.
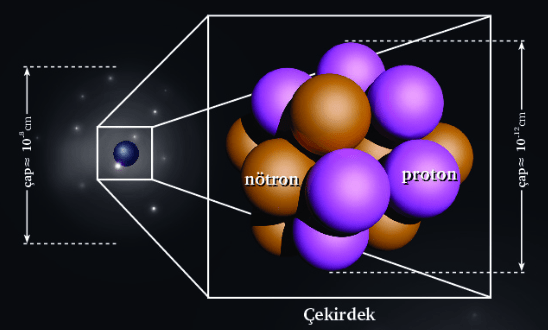
Atom çekirdek ve katmanlar olmak üzere iki bölgeden oluşmakla birlikte çekirdek çok küçük ve yoğun, katmanlar ise oldukça büyük bir hacimde büyük boşluklar bulundurur.
Çekirdekte bulunan proton her atomda kesinlikle vardır. Protonu olmayan bir tanecik atom değildir. Nötron taneciği de protonla birlikte çekirdek bölgesinde bulunur. Hidrojen atomunun bir izotopu hariç her atomda nötron bulunur.
Elektronlar ise atomun çekirdeğinin çevresinde belirli yörüngelerde dolaşan çok küçük kütleli taneciklerdir. Bir atomun bütün elektronları koparılarak elektron içermeyen bir iyon elde edilebilir.
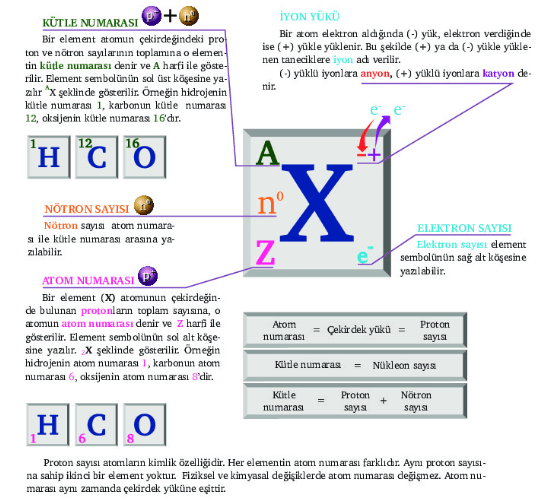
Atom Numarası
Atomun çekirdeğinde bulunan proton sayısına denir. Atom numarası elementler için ayırt edici özelliktir.
Atom çekirdeğinde bulunan pozitif yüklü tanecikler protonIardır ve çekirdekte yüklü başka tanecik yoktur. Bu nedenle proton sayısı, çekirdek yükü olarak da adlandırılmaktadır.
Proton sayısı = Atom numarası = Çekirdek yükü
Element atomlarının proton sayısı element sembolünün sol alt köşesine yazılarak gösterilir.
Kütle Numarası
Bir atomun çekirdeğinde bulunan proton ve nötron sayılarının toplamına kütle numarası denir. Kütle numarası A ile gösterilir.
Bir elementin kütle numarası sembolünün sol üst köşesine yazılarak gösterilir. Kütle numarasına nükleon sayısı da denir.
Kütle numarası = Proton sayısı + Nötron sayısı
Elektron Sayısı
Bir atomun yörüngesinde dolaşan parçacıkların sayısına elektron sayısı denir. Elektron sayısı element sembolünün sağ alt köşesine yazılır.
İyon yükü ile elektron sayısının toplamı atom numarasını
Atom numarası ile nötron sayısının toplamı kütle numarasını verir.
Nötr (yüksüz) bir atomda;
Atom numarası = Çekirdek yükü = Proton sayısı = Elektron sayısı
Yüklü bir tanecikte;
İyon yükü = Proton sayısı – Elektron sayısı
İyon Yükü
Bir atom elektron aldığında (-) yük, elektron verdiğinde ise (+) yükle yüklenir. Bu şekilde (+) ya da (-) yükle yüklenen taneciklere iyon adı verilir.
(-) yüklü iyonlara anyon,
(+) yüklü iyonlara katyon denir.
Bir atomda (+) yüklü protonların sayısı (–) yüklü elektronların sayısına eşitse böyle atoma nötr atom denir.
Bir atomun sahip olduğu yük proton sayısından elektron sayısının çıkartılması ile hesaplanır.
İyon yükü = Proton Sayısı (P) – Elektron Sayısı (e–)
Nötr atomlarda,
Proton sayısı = Elektron sayısı
Katyonlarda,
Proton sayısı > Elektron sayısı
Anyonlarda,
Elektron sayısı > Proton sayısı
– Bir atom ya da iyon elektron aldıkça yük değeri alınan elektron sayısı kadar küçülür.
– Bir atom ya da iyon elektron verdikçe yük değeri verilen elektron sayısı kadar büyür.
– Bir atom elektron verdiğinde her zaman son katmanından elektron verir.
İzotop, İzoton, İzobar Atomlar ve İzoelektronik Tanecikler
Farklı atomlar içerdikleri bazı tanecik sayılarının eşit olmasına göre farklı isimler alırlar.
İzotop Atomlar
– Çekirdeklerindeki proton sayıları eşit olan ancak farklı sayıda nötron içeren atomlar
– İzotop atomlardır. İzotop atomların atom numaraları aynı, kütle numaraları farklıdır. Bu nedenle İzotop atomlar aynı elementin farklı nötron taşıyan atomlarıdır.
– İzotop atomların kimyasal özellikleri aynı, fiziksel özellikleri farklıdır.
– Aynı elementin çok sayıda izotopu olabilmektedir.
İzoton Atomlar
Nötron sayısı aynı, proton sayısı farklı atomlara izoton atomlar denir. İzoton atomlar proton sayıları farklı olduğu için farklı atomlardır. Buna göre kimyasal ve fiziksel özellikleri farklıdır.
– İzoton atomlar farklı elementlerin eşit nötron içeren atomlarıdır.
– İzoton atomların hem kimyasal hem de fiziksel özellikleri farklıdır.
İzobar Atomlar
Çekirdeklerindeki hem proton sayıları hem de nötron sayıları farklı olan ancak proton ve nötron sayıları toplamları eşit olan atomlar izobar atomlardır.
– İzobar atomların kütle numaraları aynı, atom numaraları farklı olan atomlardır.
– İzobar atomların hem kimyasal hem de fiziksel özellikleri farklıdır.
İzoelektronik Tanecikler
– Çekirdeklerindeki proton sayıları farklı olan ancak elektron sayıları aynı olan tanecikler İzoelektronik taneciklerdir.
– İzoelektronik taneciklerde elektron sayılarının eşit olması yeterli değildir. Elektron dizilimleri farklı olmalıdır.
– Atom ve iyonları izoelektroniktir. Her bir taneciğin 10 ar tane elektronu vardır ve elektron dizilimleri aynıdır.
– İzoelektronik taneciklerden birisi nötr bir atom ise diğerleri kesinlikle iyondur.
– İzoelektronik taneciklerin hem kimyasal hem de fiziksel özellikleri farklıdır.







çok iyi bir anlatım olmuş teşekkürler <3
Aradığımı bulamadım ama yinedwie teşekkürler 🙏🙏
Aradığınız konu nedir bizde eksikliğimizi gidermiş oluruz.
atom modelleri konusu eksik sanırım( dalton atom modeli vs.)
Güzelll
Ellerinize sağlık çok güzel bir konu anlatımı olmuş…